イオン化エネルギーとは、原子や分子から1つの電子を完全に引き離すために必要なエネルギーです。
このエネルギーは、電子と原子核の相互作用エネルギー(クーロン力)と電子の運動エネルギーの和です。
剥離する前の電子が原子や分子に束縛された状態にあるため、電子と原子核の相互作用エネルギーと、電子の運動エネルギーの和に等しくなります。
電子はクーロン力で原子核に引きつけられていますから、これを引き剥がして奪おうとすれば、エネルギーが必要になります。
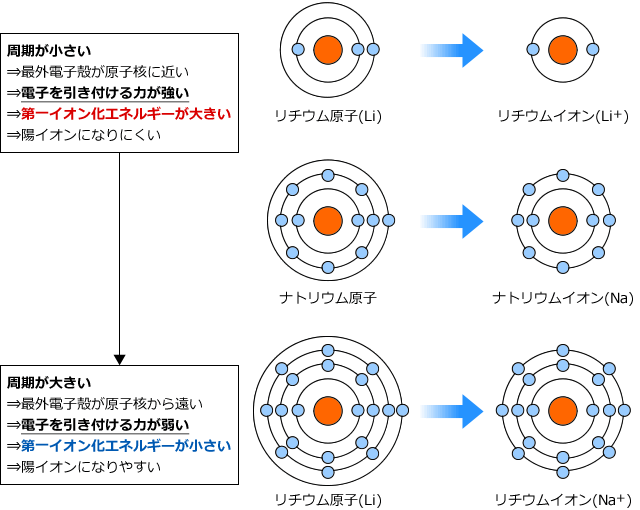
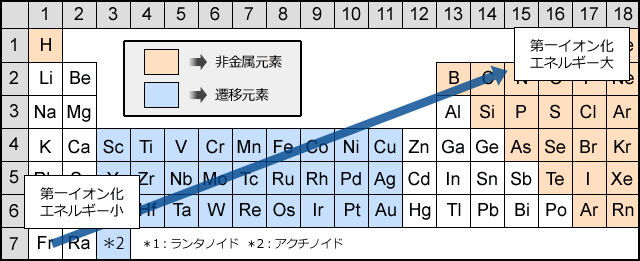
原子の最外殻電子を1つ奪って、1価の陽イオンにするのに必要なエネルギーを第一イオン化エネルギーと言い、この値が大きい原子ほど陽イオンになりにくく、小さい原子ほど陽イオンになりやすくなります。NaとClを例にして第一イオン化エネルギーについて考えてみましょう。
Naは電子を引き付ける力が弱い。もう少しいうと電子を捨てたい元素でしたね。ですから、最外殻電子を奪うにはあまり大きなエネルギーを必要としません。ちょっと引っ張れば、ぽろっと取れます。
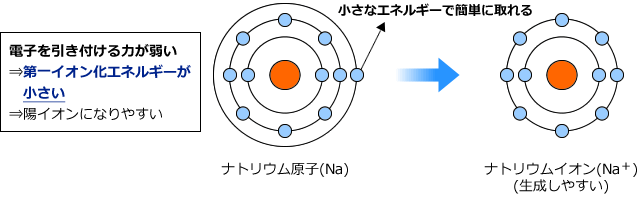
一方、Clはどうでしょうか。Clは電子をほしがっている元素ですから、なかなか電子を手放してはくれません。そこから最外殻電子を引き剥がすのは大変です。
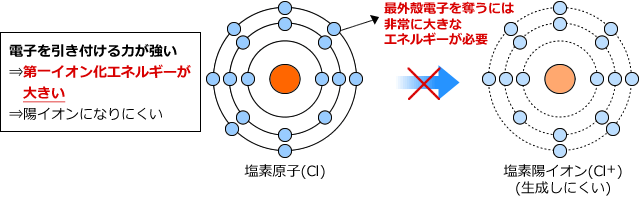
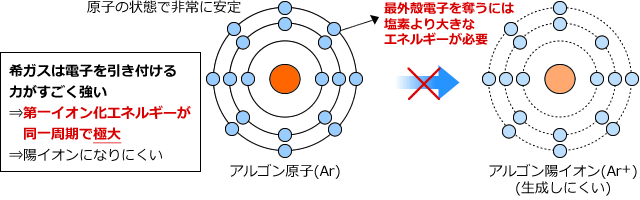
では、希ガスはどうでしょうか。希ガスは原子の状態で非常に安定ですから、陽イオンにしようとして最外殻電子を奪おうとすると、塩素の場合よりも大きなエネルギーが必要になってしまいます。
このように、周一周期で比較した場合、族番号が大きくなるほど電子を引き付ける力が強くなるため第一イオン化エネルギーも大きくなり、希ガスで最大値を取ります。
電子を引き付ける力の大きさの傾向については、前回説明した通りです。
次は、同じ族の原子で比べてみましょう。同じ族だと最外殻電子数は同じですから、電子を引き付けることができる原子核の電荷は全て同じです。しかし、周期が大きくなると、原子核と最外殻電子の距離は大きくなりますね。
最外殻電子を引き付けている正電荷の大きさは、(原子核の陽子数)―(内殻の電子数)で表されます。
そうすると、同じ族で考えると最外殻電子を引き付けている陽子数は同じになります。アルカリ金属を例にとって説明しますね。
あ、内殻というのは最外殻より内側の電子殻の事で、Liなら最外殻がL殻ですから内殻はK殻、Naは最外殻がM殻なので、内殻はK殻とL殻です。
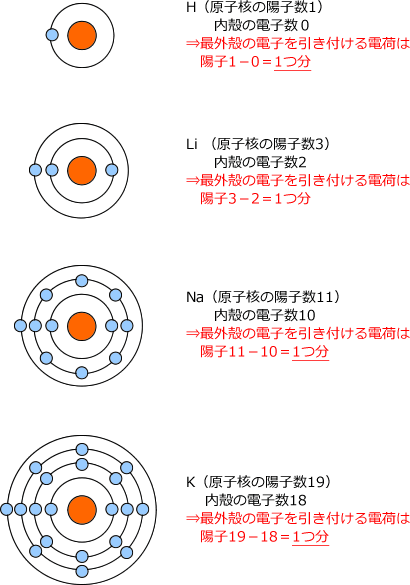
どうですか。原子番号が大きくなって陽子数が多くなっても、最外殻電子を引き付けている電荷の大きさは陽子1つ分で変化しませんね。
このように原子核を取り巻いている内殻の電子が陽子の電荷を打ち消すことを遮蔽と言います。
すると、以前も説明したようにクーロン力は距離の二乗に反比例しますから、周期が大きくなるほど最外殻電子を引き付ける力は弱くなり、第一イオン化エネルギーは小さく、陽イオンになりやすくなります。
原子番号を横列、イオン化エネルギーを縦列にとってグラフを描くと、下図のようになります。
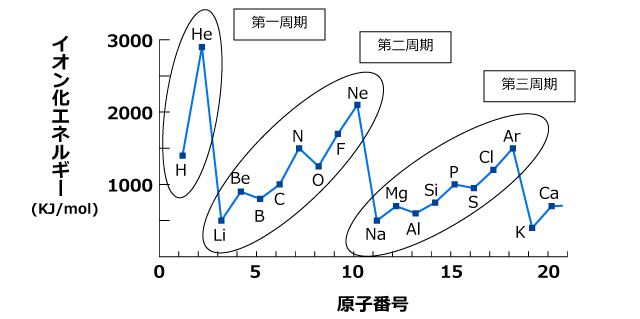
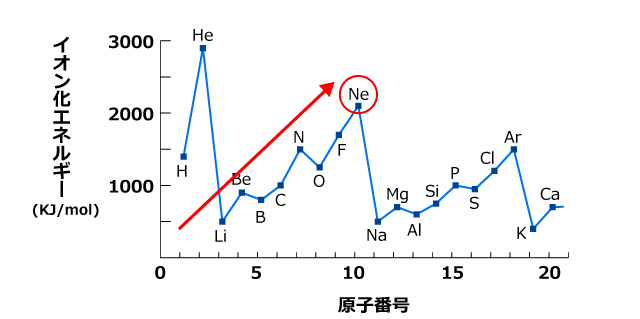
同じ周期の中で比較すると、希ガス元素の第一イオン化エネルギーが極大になっていますね。
また、各周期の希ガス元素を比較すると、周期が大きくなるほどイオン化エネルギーが小さくなるのがわかりますね。
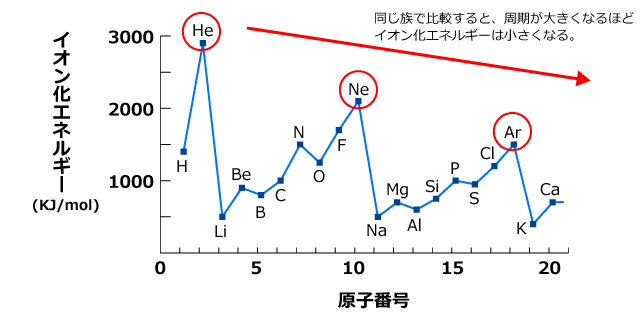
このように、第一イオン化エネルギーは族番号が大きいほど、周期が小さいほど大きくなります。つまり、周期表の右上ほど大きく、左下ほど小さくなるのです。


コメント